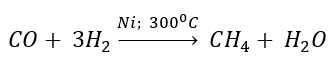শিখনফল:
- সম্পৃক্ত হাইড্রোকার্বন কাকে বলে বলতে পারবে।
- অ্যালকেন কাকে বলে বলতে পারবে।
- পরীক্ষাগারে অ্যালকেন প্রস্তুতির বিক্রিয়া লিখতে পারবে।
- শিল্পক্ষেত্রে অ্যালকেন প্রস্তুতির বিক্রিয়া লিখতে পারবে।
- অ্যালকেনের অন্যান্য প্রস্তুতির বিক্রিয়া লিখতে পারবে।
- অ্যালকেনের হ্যালোজিনেশন, নাইট্রেশন, তাপীয় বিয়োজন ইত্যাদি বিক্রিয়া লিখতে পারবে।
- অ্যালকেনের হ্যালোজিনেশন বিক্রিয়ার কৌশল লিখতে পারবে।
প্রথমেই আমরা দেখি
সম্পৃক্ত হাইড্রোকার্বন বা অ্যালকেন কী-
শুধুমাত্র কার্বন ও
হাইড্রোজেন দ্বারা গঠিত যৌগের কার্বন শিকলে কেবল সিগমা (σ) বন্ধন অর্থাৎ কার্বন-কার্বন একক বন্ধন
থাকলে তাদের সম্পৃক্ত হাইড্রোকার্বন বা অ্যালকেন বলে। এদের সাধারণ সংকেত হল CnH2n+2। যেমন: মিথেন (CH4), বিউটেন (CH3-CH2-CH2-CH3)
ইত্যাদি। এদের কার্বন শিকল সম্পৃক্ত
থাকায় এরা রাসায়নিকভাবে কম সক্রিয় তাই এদেরকে প্যারাফিন (‘parum অর্থ a little বা স্বল্প এবং affinis অর্থ affinity বা আসক্তি’) বলা হয়।
অ্যালকেনের
প্রস্তুতি:
পরীক্ষাগারে-
সাধারণত
কার্বোক্সিলিক এসিডের সোডিয়াম লবণের সাথে সোডালাইমের (NaOH+CaO) মিশ্রণকে তীব্রভাবে উত্তপ্ত করে
অ্যলকেন প্রস্তুত করা হয়।
তাহলে পরীক্ষাগারে মিথেন
ও ইথেন প্রস্তুতির বিক্রিয়া হবে-
শিল্পক্ষেত্রে-
(i) কার্বন মনোক্সাইড ও হাইড্রোজেন এর
মিশ্রণকে 3000C
তাপমাত্রায় উত্তপ্ত নিকেল চূর্ণের উপর দিয়ে চালনা করে মিথেন
উৎপন্ন করা হয়-
(ii) কার্বন মনোক্সাইড ও স্টীমের মিশ্রণকে 2500-2700C তাপমাত্রায়
নিকেল কার্বনেট প্রভাবকের ওপর দিয়ে চালনা করে মিথেনের শিল্পোৎপাদন করা হয়।
অ্যালকেন
প্রস্তুতির আরও কিছু বিক্রিয়া-
ক.
অসম্পৃক্ত হাইড্রোকার্বনে H2 সংযোজন
খ.
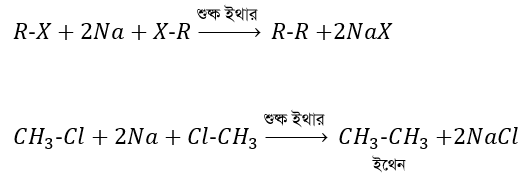
উর্টজ বিক্রিয়া:
শুষ্ক ইথারে দ্রবীভূত অ্যালকাইল হ্যালাইডের সাথে ধাতব সোডিয়ামের বিক্রিয়ায়
অ্যালকেন উৎপন্ন হয়। এ বিক্রিয়াকে উর্টজ বিক্রিয়া বলে।
এই বিক্রিয়ার সাহায্য
নিম্ন কার্বন বিশিষ্ট অ্যালকাইল হ্যালাইড থেকে উচ্চতর (মূল অ্যালকাইল হ্যালাইডের কার্বনের
দ্বিগুন কার্বন বিশিষ্ট) অ্যালকেন প্রস্তুত করা যায়।
যেমন ইথাইল আয়োডাইড থেকে
বিউটেন প্রস্তুত করা যায়-
একক অ্যলকাইল
হ্যলাইডের দুটি অণুর পরিবর্তে উর্টজ বিক্রিয়ায় যদি একাধিক অ্যালকাইল হ্যালাইডের
মিশ্রণ ব্যবহার করা হয় তবে উচ্চতর অ্যালকেনের মিশ্রণ পাওয়া যায়। এভাবে উর্টজ
বিক্রিয়ার মাধ্যমে বিজোড় সংখ্যক কার্বনের অ্যালকেন ( যেমন: প্রোপেন) প্রস্তুত করা
সম্ভব হয়-
গ.
অ্যালকাইল হ্যালাইডের বিজারণ: Na-C2H5OH অথবা Zn-HCl এর মিশ্রণ হতে উৎপন্ন জায়মান হাইড্রোজেন
[H+]
দ্বারা অ্যালকাইল হ্যালাইডকে বিজারণ করলে অ্যালকেন উৎপন্ন হয়।
ঘ.
কার্বোক্সিলিক এসিডের লবণের ডিকার্বোক্সিলেশন দ্বারা: কার্বোক্সিলিক এসিডের সোডিয়াম লবণের
সাথে সোডালাইমের (NaOH+CaO)
মিশ্রণকে তীব্রভাবে উত্তপ্ত করলে অ্যলকেন পাওয়া যায়।
ঙ.
গ্রিগনার্ড বিকারক থেকে:
গ্রিগনার্ড বিকারক (অ্যালকাইল ম্যাগনেসিয়াম হ্যালাইডকে গ্রিগনার্ড বিকারক বলে) ও
পানির বিক্রিয়ায় অ্যালকেন পাওয়া যায়।
চ. কোব সংশ্লেষণ: কার্বোক্সিলিক এসিডের সোডিয়াম লবণের গাঢ় জলীয় দ্রবণকে তড়িৎ বিশ্লেষণ করলে অ্যানোডে উচ্চতর অ্যালকেন উৎপন্ন হয়।
অ্যালকেনের
বিক্রিয়া-
সুদৃঢ় একক সিগমা (σ) বন্ধনের
কারণে অ্যালকেনকে প্যারাফিন বলা
হয়। প্যারাফিন অর্থ রাসায়নিকভাবে আসক্তিহীন। তবে কিছু বিশেষ শর্তে অ্যালকেন
নিম্নোক্ত বিক্রিয়া দেয়-
অ্যালকেনের হ্যালোজেনেশন-
মৃদু
সূর্যালোক বা অতিবেগুনি রশ্মির উপস্থিতিতে বা উচ্চ তাপমাত্রায় অ্যালকেনের
হাইড্রোজেন পরমানু হ্যালোজেন (Cl2, Br2) দ্বারা প্রতিস্থাপিত হয়। যেমন, সূর্যালোকের উপস্থিতিতে
CH4 ও
Cl2 এর
বিক্রিয়ায় মিথেনের চারটি H পরমাণু একে একে Cl
পরমাণু দ্বারা
প্রতিস্থাপিত হয়ে যথাক্রমে মিথাইল ক্লোরাইড (CH3Cl), মিথিলিন ক্লোরাইড (CH2Cl2),
ক্লোরোফরম
(CHCl3),
ও কার্বন টেট্রাক্লোরাইড (CCl4) উৎপন্ন হয়।
(I2 হ্যালোজেন প্রতিস্থাপন বিক্রিয়া দেয় না।
30>20>10 H পরমাণুতে প্রতিস্থাপন ঘটে)
হ্যালোজিনেশন
বা ক্লোরিনেশেনের বিক্রিয়া কৌশল-
অ্যালকেনের হ্যালোজিনেশন
বিক্রিয়া মৃদু সূর্যালোক, তাপ অথবা অতিবেগুণী রশ্মির (396Kjmol-1) প্রভাবে মুক্ত মূলক বিক্রিয়া কৌশল
অর্থাৎ ফ্রী-রেডিক্যাল মেকানিজম অনুসারে ৩ ধাপে ঘটে-
সূচনা
স্তর (১ম ধাপ):
এ স্তরে আলো বা তাপশক্তির
প্রভাবে ক্লোরিন (Cl2) অণুর সুষম ভাঙনে ক্লোরিন
ফ্রি-রেডিক্যাল (.Cl) উৎপন্ন হয়।
বিস্তারণ
স্তর (২য় ধাপ): উৎপন্ন
ক্লোরিন ফ্রি-রেডিক্যাল অ্যালকেনের C-H বন্ধনকে আক্রমন করে HCl
ও অ্যালকাইল (.R)
ফ্রি-রেডিক্যাল উৎপন্ন
করে। এ সক্রিয় অ্যালকাইল (.R) ফ্রি-রেডিক্যাল অপর একটি ক্লোরিন (Cl2) অণুর সঙ্গে বিক্রিয়ায় অ্যালকাইল
ক্লোরাইড (RCl) ও নতুন ক্লোরিন ফ্রি-রেডিক্যাল (.Cl) উৎপন্ন
করে। এ ধাপ বিক্রিয়ার
পুনারাবৃত্তি ঘটতে থাকে। তাই এ ধরণের বিক্রিয়াকে চেইন বিক্রিয়া বলে।
সমাপ্তি স্তর (৩য়
ধাপ): বিভিন্ন ফ্রি-রেডিক্যাল যুক্ত হয়ে বিক্রিয়া শেষ হয়।
ফ্রী-রেডিক্যালের
স্থায়ীত্ব ও বিক্রিয়ার ক্রম-
ফ্রী-রেডিক্যালের
স্থায়ীত্বের ক্রম 30>20>10 -এর কারণ-
সমযোজী সিগমা বন্ধনের সুষম ভাঙনের ফলে
উৎপন্ন বিজোড় ইলেকট্রনযুক্ত পরমাণু বা মূলককে মুক্ত মূলক বা ফ্রি-রেডিক্যাল বলে।
যেমন: মিথাইল ফ্রি-রেডিক্যাল CH3● , ক্লোরিন ফ্রি-রেডিক্যাল ●Cl ইত্যাদি। উৎপন্ন ফ্রী-রেডিক্যালে ইলেকট্রনের
ঘাটতি থাকে।
ইলেকট্রনের ঘাটতিযুক্ত অ্যালকাইল ফ্রী-রেডিক্যালের
কার্বন পরমাণুতে যদি ইলেকট্রন বিকর্ষী মূলক যেমন মিথাইল (CH3-), ইথাইল (C2H5-) ইত্যাদি যুক্ত থাকে তবে সেটি ইলেকট্রনের
ঘাটতিযুক্ত অ্যালকাইল ফ্রী-রেডিক্যালের কার্বন এর চারপাশে ইলেকট্রন এর ঘনত্ব
বৃদ্ধি করে। তাই ফ্রী-রেডিক্যালের
এর কার্বন পরমাণুতে যত বেশি সংখ্যক অ্যালকাইল মূলক যুক্ত থাকে সেটি তত বেশী স্থায়ী
হয়। তাই ফ্রী-রেডিক্যালের স্থায়ীত্বের ক্রম 30>20>10
।
আর যে ফ্রী-রেডিক্যাল
যত বেশী স্থায়ী সেটি তত বেশী সক্রিয়।
অর্থাৎ সেটি বেশী উৎপন্ন হবে। আর যেহেতু ফ্রী-রেডিক্যালের স্থায়ীত্বের ক্রম 30>20>10
এবং আমরা জানি, অ্যলকেনের হাইড্রোজেন
পরমাণুর প্রতিস্থাপন মূলত ফ্রী-রেডিক্যাল মেকানিজম অনুসারে ঘটে থাকে তাই হাইড্রোজেন পরমাণুর প্রতিস্থাপনও এই
ক্রমে 30>20>10 কার্বনে ঘটবে।
ব্যাখ্যা
কর-প্রোপেনের ব্রোমিনেশনে ৯৭% ২-ব্রোমোপ্রোপেন আর ৩% ব্রোমোপ্রোপেন উৎপন্ন হয়।
অ্যালকেনের
নাইট্রেশন বিক্রিয়া-
প্রায় 4000C
তাপমাত্রায় অ্যালকেন ও
গাঢ় HNO3 এর
বাষ্পকে একত্রে উত্তপ্ত করলে অ্যালকেনের হাইড্রোজেন (H)
পরমাণু নাইট্রো (NO2)
মূলকদ্বারা প্রতিস্থাপিত
হয়ে নাইট্রো অ্যালকেন প্রস্তুত হয়।
অ্যালকেনের
তাপীয় বিযোজন: উচ্চ
চাপে ও তাপমাত্রায় তাপীয় ভাঙনে অথবা প্রভাবকের উপস্থিতিতে অপেক্ষাকৃত
নিম্নতাপমাত্রায় প্রভাকীয় ভাঙনে বৃহত্তর অ্যালকেন ভেঙে ক্ষুদ্রতর অ্যালকেন ও
অ্যালকিনের মিশ্রণ উৎপন্ন হয়। বিযোজনের ফলে সৃষ্ট অণুর প্রকৃতি নির্ভর করে
অ্যালকেন অনুর আকৃতি, তাপ, চাপ, প্রভাবক ইত্যাদির উপর। এ বিক্রিয়ার সাহায্যে বৃহত্তর
অ্যালকেন থেকে ক্ষুদ্রতর অ্যালকেন প্রস্তুত করা যায়-
অ্যালকেনের
সমাণুকরণ বিক্রিয়া:
অনার্দ্র AlCl3
ও HCl
গ্যাসের মিশ্রণের
উপস্থিতিতে 2500-3000c তাপমাত্রায়
n-অ্যালকেনের সমাণুকরণ
বিক্রিয়ায় শাখাযুক্ত iso-অ্যালকেন উৎপন্ন হয়-
এভাবে একইভাবে কম
শাখাযুক্ত অ্যালকেন থেকে বেশি শাখাযুক্ত অ্যালকেন প্রস্তুত করা যায়।
অকটেন
নাম্বার
কোন পেট্রোল ইঞ্জিনে
জ্বালানিরূপে গ্যাসোলিন ব্যবহারের ফলে ইঞ্জিনে যে পরিমাণ ধাক্কা বা নকিং সৃষ্টি
করে, সে একই পরিমাণ নকিং সেই ইঞ্জিনে সৃষ্টি করতে ব্যবহৃত iso-অকটেন ও n-হেপ্টেনের কোন মিশ্রণে যে শতকরা পরিমাণ iso-অকটেনের দরকার হয়, iso-অকটেনের সেই শতকরা পরিমাণ কে ঐ
গ্যাসোলিন জ্বালানির অকটেন নাম্বার বলে।
কোন মোটর জ্বালানির অকটেন নাম্বার 85
বলতে বোঝায় ঐ জ্বালানিটি 15% n-হেপ্টেন ও 85% iso-অকটেন মিশ্রণের সমান জ্বালানি
ক্ষমতাসম্পন্ন তৈল। যে জ্বালানির অকটেন নাম্বার যত বেশি সে জ্বালানি তত বেশী
উৎকৃষ্ট।
জ্বালানির
অকটেন নাম্বার বৃদ্ধির উপায়-
১। উচ্চতর অ্যলকেনের
তাপীয় বিযোজনের মাধ্যমে:
২। অ্যালকেনের
সমাণুকরণ বিক্রিয়ার মাধ্যমে: