শিখনফল-
- অ্যালকাইন কাকে বলে বলতে পারবে।
- অ্যালকাইনের ধর্ম ও বৈশিষ্ট্য ব্যাখ্যা করতে পারবে।
- অ্যালকাইনের শিল্পোৎপাদন বিক্রিয়া লিখতে পারবে।
- অ্যালকাইনের পরীক্ষাগার প্রস্তুতি লিখতে পারবে।
- অ্যালকাইনের রাসায়নিক সক্রিয়তা ব্যাখ্যা করতে পারবে।
- অ্যালকাইনের অম্লধর্মীতা ব্যাখ্যা করতে পারবে।
- অ্যালকাইনের সাথে বিভিন্ন যৌগের সংযোজন বিক্রিয়া ব্যাখ্যা করতে পারবে।
- অ্যালকাইনের ওজোনীকরণ বিক্রিয়া লিখতে পারবে।
- বিক্রিয়ার মাধ্যমে অ্যালকাইনে ত্রিবন্ধনের অবস্থান নির্ণয় করতে পারবে।
- অ্যালকাইনের জারণ বিক্রিয়া লিখতে পারবে।
- অ্যালকাইন শনাক্তকরণ করতে পারবে।
- অ্যালকাইন-১ ও অ্যালকাইন-২ এর মধ্যে পার্থক্য করতে পারবে।
- ইথেন, ইথিন ও ইথাইনের মিশ্রণ পৃথক করার বিক্রিয়া লিখতে পারবে।
অ্যালকেন-
যে সব হাইড্রোকার্বনের মুক্ত কার্বন শিকলে একটি মাত্র
কার্বন-কার্বন ত্রিবন্ধন থাকে তাদেরকে অ্যালকাইন বলে। অ্যালকাইনের সাধারণ সংকেত CnH2n-2। যেমন: ইথাইন ($C_2H_2$), ২-বিউটাইন ($H_3C-C\equiv C-CH_3$) ইত্যাদি।
অ্যালকাইনের প্রস্তুতি-
শিল্পক্ষেত্রে-
ডাইহ্যালো অ্যালকেন থেকেঃ ভিসিন্যাল ও জেমিন্যাল ডাইহ্যালো অ্যালকেনকে অ্যালকোহলে
দ্রবীভূত কস্টিক পটাশের সাথে উত্তপ্ত করলে ডাইহ্যালো অ্যালকেন থেকে দুই অণু HX
অপসারিত হয়ে অ্যালকাইন উৎপন্ন হয়। যেমন-
১. ভিসিন্যাল ডাইহ্যালাইড থেকেঃ

১. ভিসিন্যাল ডাইহ্যালাইড থেকেঃ
কিভাবে 1, 2 ডাইব্রোমো প্রোপেন থেকে প্রোপাইন
প্রস্তুত করবে?
২. জেমিন্যাল ডাইহ্যালাইড থেকেঃ
2, 2 -ডাইব্রোমোপ্রোপেন থেকে প্রোপাইন প্রস্তুতিঃ
পরীক্ষাগারে-
সাধারণ তাপমাত্রায় ক্যালসিয়াম কার্বাইড ($CaC_2$) এর উপর পানি যোগ করলে ক্যালসিয়াম কার্বাইড আর্দ্র বিশ্লেষিত হয়ে ইথাইন গ্যাস ও ক্যালসিয়াম হাইড্রোক্সাইড উৎপন্ন হয়।
$$CaC_2 + 2H_2O \longrightarrow H-C\equiv C-H + Ca(OH)_2$$
অ্যালকাইনের বিক্রিয়া-
অ্যালকাইনে একটি σ ও দুটি π বন্ধন আছে। তাই অ্যালকিনের π বন্ধনের মত অ্যালকাইন ও অনুরূপ সংযোজন, জারন, ওজোনীকরণ, পলিমারকরণ ইত্যাদি
বিক্রিয়া দেয়।
তবে সক্রিয়তার দিক থেকে অ্যালকাইনসমূহ অ্যালকিন থেকে কম সক্রিয়।
অ্যালকাইনের সক্রিয়তা-
অ্যালকিন পরমাণুর দ্বিবন্ধনে কার্বন পরমাণু দুটির প্রত্যেকটি sp2 -সংকরণ দ্বারা তিনটি সংকর অরবিটাল তৈরী করে। এসব সংকর অরবিটালে 33.3% s-চরিত্র ও 66.7% p-চরিত্র থাকে। অপরদিকে অ্যালকাইন পরমাণুর ত্রিবন্ধনে কার্বন পরমাণু দুটির প্রত্যেকটি sp -সংকরণ দ্বারা দুটি সংকর অরবিটাল তৈরী করে। এসব সংকর অরবিটালে 50% s -চরিত্র এবং 50% p -চরিত্র থাকে। অ্যালকিনের ত্রিবন্ধনে s -চরিত্র বেশি হওয়ায় কার্বন পরমাণুর দুটির নিউক্লিয়াসের σ ইলেকট্রণ মেঘ কাছাকা্ছি সরে আসে ফলে π ইলেকট্রণ মেঘের ঘনত্ব ও বৃদ্ধি পায়। অর্থাৎ অ্যালকিনের দ্বিবন্ধনের π-বন্ধনের চেয়ে অ্যালকাইনের ত্রিবন্ধনের π বন্ধন বেশি শক্তিশালী হয়। তাই রাসায়নিক ভাবে অ্যালকাইন অ্যালকিনের চেয়ে কম সক্রিয় হয়।
অ্যালকিন পরমাণুর দ্বিবন্ধনে কার্বন পরমাণু দুটির প্রত্যেকটি sp2 -সংকরণ দ্বারা তিনটি সংকর অরবিটাল তৈরী করে। এসব সংকর অরবিটালে 33.3% s-চরিত্র ও 66.7% p-চরিত্র থাকে। অপরদিকে অ্যালকাইন পরমাণুর ত্রিবন্ধনে কার্বন পরমাণু দুটির প্রত্যেকটি sp -সংকরণ দ্বারা দুটি সংকর অরবিটাল তৈরী করে। এসব সংকর অরবিটালে 50% s -চরিত্র এবং 50% p -চরিত্র থাকে। অ্যালকিনের ত্রিবন্ধনে s -চরিত্র বেশি হওয়ায় কার্বন পরমাণুর দুটির নিউক্লিয়াসের σ ইলেকট্রণ মেঘ কাছাকা্ছি সরে আসে ফলে π ইলেকট্রণ মেঘের ঘনত্ব ও বৃদ্ধি পায়। অর্থাৎ অ্যালকিনের দ্বিবন্ধনের π-বন্ধনের চেয়ে অ্যালকাইনের ত্রিবন্ধনের π বন্ধন বেশি শক্তিশালী হয়। তাই রাসায়নিক ভাবে অ্যালকাইন অ্যালকিনের চেয়ে কম সক্রিয় হয়।
ইথাইন ইথিনের তুলনায় অধিক অম্লধর্মী-
ইথিন পরমাণুর দ্বিবন্ধনে কার্বন পরমাণু দুটির প্রত্যেকটি sp2
-সংকরণ দ্বারা তিনটি
সংকর অরবিটাল তৈরী করে। এসব সংকর অরবিটালে 33.3% s-চরিত্র ও 66.7% p-চরিত্র থাকে। অপরদিকে ইথাইন পরমাণুর
ত্রিবন্ধনে কার্বন পরমাণু দুটির প্রত্যেকটি sp -সংকরণ দ্বারা দুটি সংকর অরবিটাল তৈরী
করে। এসব সংকর অরবিটালে 50% s -চরিত্র
এবং 50% p -চরিত্র থাকে। অর্থাৎ
ইথিন ও ইথাইনের $-C-H$ বন্ধনে যথাক্রমে s- চরিত্র বৃদ্ধি পায় ও p- চরিত্র হ্রাস পায়। ফলে $-C-H$ বন্ধনের ইলেকট্রণ মেঘ ক্রমে কার্বন পরমাণুর দিকে
বেশি আকৃষ্ট হয় এবং প্রোটন দান ক্ষমতা বৃদ্ধি পায়। তাই ইথাইন ইথিনের তুলনায় অধিক
অম্লধর্মী।
অ্যালকাইন -১($-C\equiv C-H$) এর ১ নং কার্বনে শুধুমাত্র হাইড্রোজেন (H) যুক্ত থাকে বলে এরা মৃদু অম্লধর্ম
প্রকাশ করে। এর কারণ হচ্ছে ত্রিবন্ধনের sp সংকরণে s- চরিত্র বৃদ্ধি পাওয়ার ফলে $-C-H$ বন্ধনের ইলেকট্রণ মেঘ ক্রমে কার্বন
পরমাণুর দিকে সরে আসে এবং বন্ধনটি দূর্বল হয়ে প্রোটন দান ক্ষমতা বৃদ্ধি পায়। তাই
ইথাইন মৃদু অম্ল ধর্ম প্রকাশ করে এবং নিম্নোক্ত বিক্রিয়া দেয়।
১। Na
-এর সাথে: ইথাইন Na -এর সাথে বিক্রিয়া করে সোডিয়াম
অ্যাসিটিলাইড ও $H_2$ গ্যাস উৎপন্ন করে
$$H-C\equiv C-H + 2Na
\xrightarrow [] {liquid NH_3}Na.C\equiv C.Na(s)\downarrow + H_2 (g)$$
$$R-C\equiv C-H + 2Na \xrightarrow [] {liquid NH_3} 2R-Na.C\equiv C.Na(s)\downarrow + H_2$$
$$R-C\equiv C-H + 2Na \xrightarrow [] {liquid NH_3} 2R-Na.C\equiv C.Na(s)\downarrow + H_2$$
২। অ্যামোনিয়া যুক্ত সিলভার নাইট্রেটের
সাথে: অ্যামোনিয়া যুক্ত সিলভার
নাইট্রেটের সাথে অ্যালকাইন-১ বিক্রিয়া করে সিলভার অ্যালকানাইড এর সাদা অধঃক্ষেপ
উৎপন্ন করে।
$$R-C\equiv C-H + Ag(NH_3)_2NO_3(aq) \longrightarrow R.C\equiv C.Ag(s)\downarrow + NH_4NO_3 + NH_3$$
$$H-C\equiv C-H + Ag(NH_3)_2NO_3(aq) \longrightarrow Ag.C\equiv C.Ag(s)\downarrow + NH_4NO_3 + NH_3$$
৩। অ্যামোনিয়া যুক্ত কিউপ্রাস ক্লোরাইড
এর সাথে: অ্যামোনিয়া
যু্ক্ত কিউপ্রাস ক্লোরাইডের সাথে অ্যালকাইন-১
বিক্রিয়া করে কপার অ্যালকানাইড লাল অধঃক্ষেপ উৎপন্ন করে।
$$R-C\equiv C-H + Cu(NH_3)_2Cl \longrightarrow R.C\equiv C.Cu(s)\downarrow + NH_4Cl + NH_3$$
$$H-C\equiv C-H + Cu(NH_3)_2Cl \longrightarrow Cu.C\equiv C.Cu(s)\downarrow + NH_4Cl + NH_3$$
অ্যালকাইনের সংযোজন বিক্রিয়া-
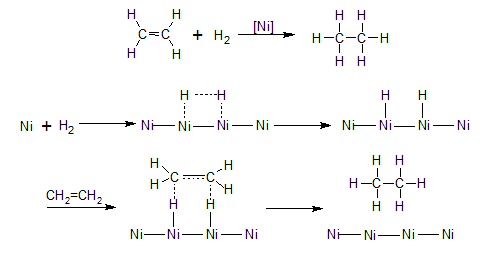
H2 সংযোজন: Pt, Pd বা Ni প্রভাবকের
উপস্থিতিতে অ্যালকাইনের সঙ্গে 1500-1800C তাপমাত্রায় হাইড্রোজেন যুক্ত
হয়ে প্রথমে অ্যালকিন ও শেষে অ্যালকেন উৎপন্ন হয়।
$$CH_3-C\equiv CH + H_2
\xrightarrow [180^0C] {Ni} CH_3-CH=CH_2 + H_2 \xrightarrow [180^0C] {Ni}
CH_3-CH_2-CH_3$$
ইথাইন থেকে ইথিন উৎপাদন-
কক্ষ তাপমাত্রায় Pd
ও BaSO4 – এর উপস্থিতিতে ইথাইন ও H2 -এর বিক্রিয়ায় ইথিন উৎপন্ন হয়।
এক্ষেত্রে BaSO4 –
প্রভাবক বিষরূপে Pd -এর
প্রভাবন ক্ষমতা হ্রাস করে তাই উৎপন্ন ইথাইন H2 -এর সাথে বিক্রিয়া করে ইথিনে পরিণত হতে
পারে না।
$$CH_2\equiv CH_2 + H_2
\xrightarrow [BaSO_4] {Pd} H_2C=CH_2$$
HX সংযোজন: অ্যালকাইনের সঙ্গে HX উত্তপ্ত অবস্থায় সংযোজিত হয়ে প্রথমে
অপ্রতিসম মনো হ্যালোজেন জাতক এবং পরে মার্কনিকভ নিয়ম অনুসারে gem ডাই -হ্যালাইড উৎপন্ন করে।
$$R-C\equiv C-R + HX \xrightarrow R-CH=CRX \overset{HX}{\longrightarrow} R-CH_2-CRX_2$$
যেমন: 2000-2500C তাপমাত্রায় HgCl2 এর উপস্থিতিতে ইথাইন শুষ্ক HCl এর সাথে বিক্রিয়া করে প্রথমে ভিনাইল
ক্লোরাইড উৎপন্ন করে পরে ভিনাইল ক্লোরাইড অতিরিক্ত HCl এর সাথে বিক্রিয়া করে ১,
১-ডাইক্লোরোইথেন উৎপন্ন করে।
$$CH\equiv CH + HCl (g) \xrightarrow [250^0C] {HgCl_2} CH_2=CHCl$$
$$CH_2=CHCl + HCl (g) \longrightarrow CH_3-CHCl_2$$
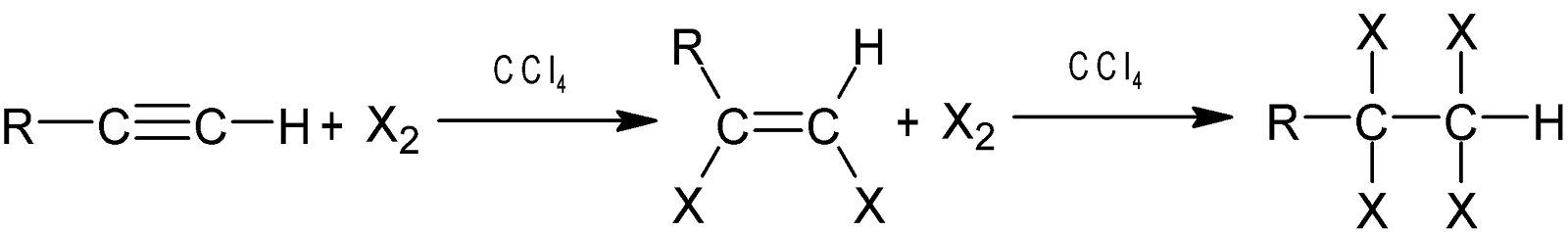


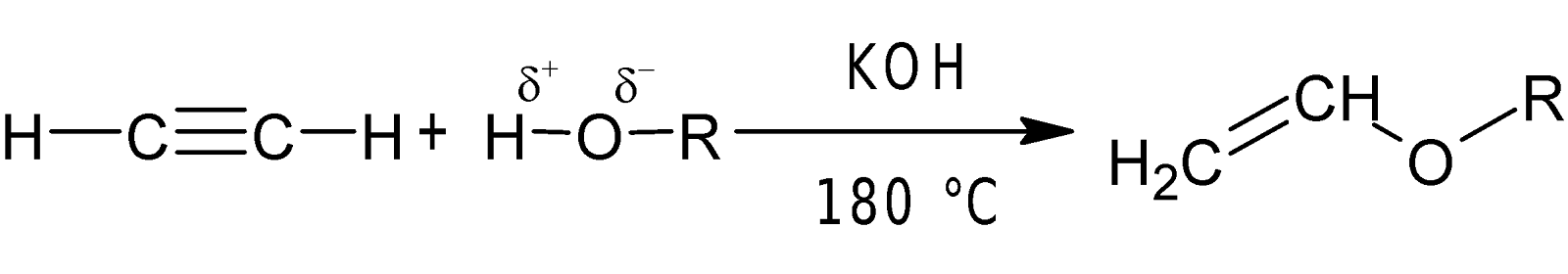









X2 সংযোজন: সাধারণ তাপমাত্রায়
হ্যালোজেন অ্যালকাইনের
সঙ্গে বিক্রিয়া করে প্রথমে ডাই-হ্যালাইড ও পরে টেট্রাহ্যালাইড উৎপন্ন করে।
যেমন: ইথাইনের সাথে $Br_2$ এর
বিক্রিয়ায় প্রথমে ১, ২-ডাইব্রোমো ইথিন এবং পরে ১,১,২,২- টেট্রাব্রোমো ইথেন উৎপন্ন
হয়।
এ বিক্রিয়ায় $Br_2$
-এর লাল বর্ণ দুরীভূত হয় বলে এ বিক্রিয়ার
সাহায্যে অ্যালকাইনের অসম্পৃক্ততা বা π -বন্ধনের উপস্থিতি নির্ণয় করা যায়।
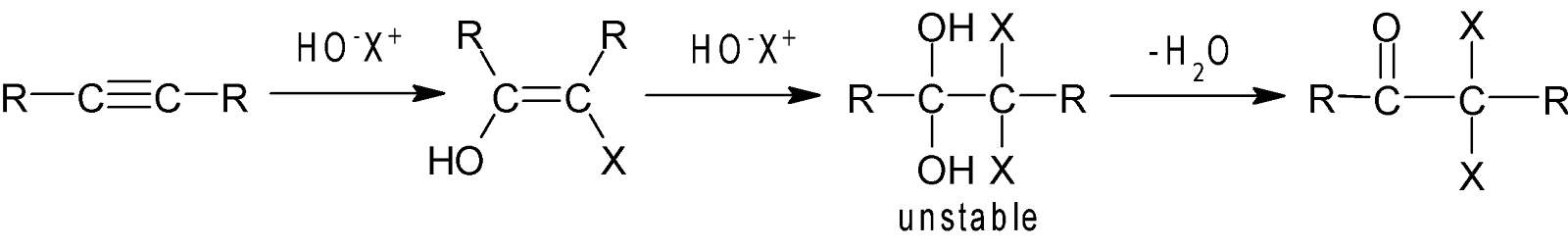
HOX সংযোজন: হাইপোহ্যালাস এসিড
অ্যালকিনের সাথে দুধাপে
বিক্রিয়া করে প্রথম ধাপে enol এবং দ্বিতীয় ধাপে ডাইহ্যালো কিটোন উৎপন্ন করে।
যেমন: ইথাইন হাইপো
ক্লোরাস এসিড (HOCl) -এর
সাথে বিক্রিয়া করে ডাইক্লোরো অ্যাসিটালডিহাইড উৎপন্ন করে।
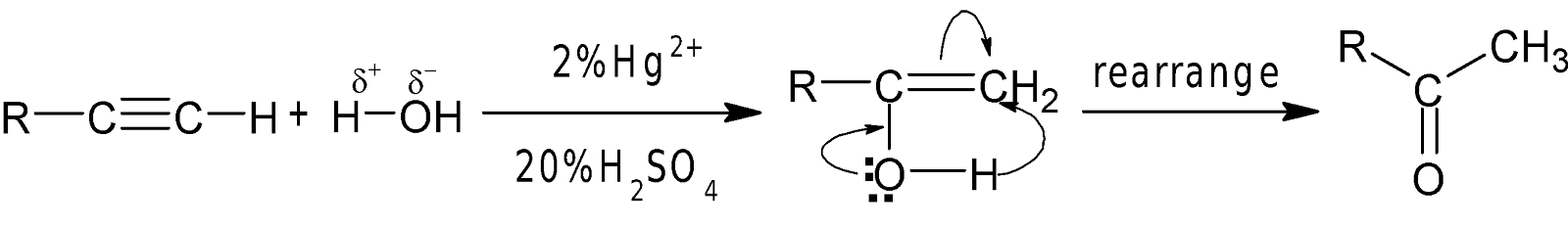
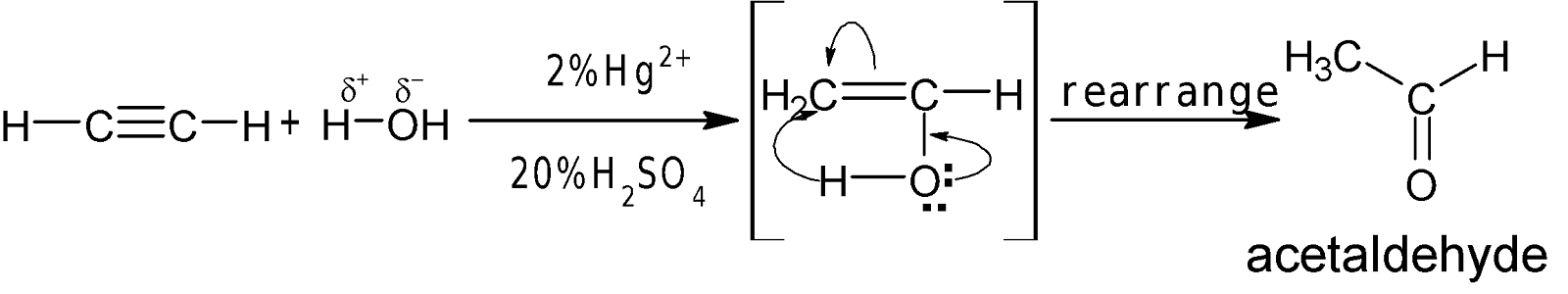
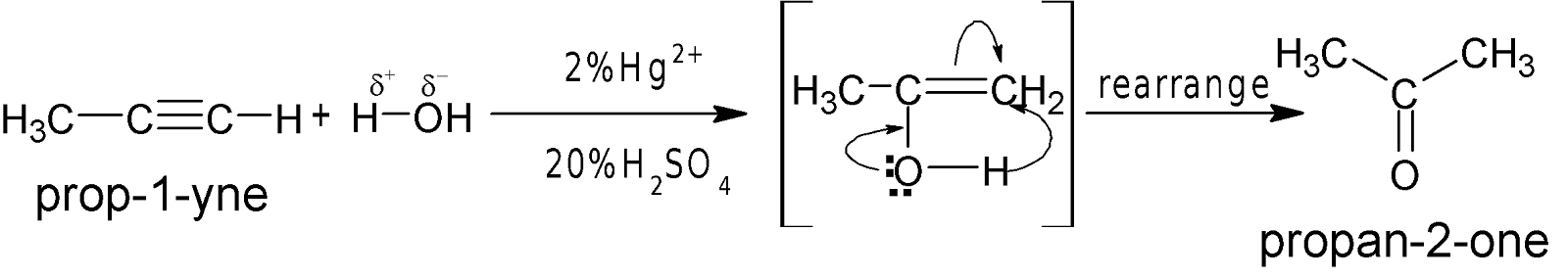
H2O সংযোজন: লঘু $H_2SO_4$-এ দ্রবীভূত 2%
মারকিউরিক সারফেটের
উপস্থিতিতে 600-750C তাপমাত্রায় পানির সঙ্গে অ্যালকাইন যুক্ত
হয়ে কার্বানাইল যৌগ গঠন করে।
যেমন: লঘু $H_2SO_4$-এ দ্রবীভূত 2% মারকিউরিক সারফেটের উপস্থিতিতে 600-750C
তাপমাত্রায় পানির সঙ্গে ইথাইন
যুক্ত হয়ে কার্বানাইল যৌগ গঠন করে।
উৎপন্ন ইথান্যালকে ম্যাঙ্গানাস অ্যাসিটেট প্রভাবকের উপস্থিতিতে
অক্সিজেন দ্বারা জারিত করলে অ্যাসিটিক এসিড উৎপন্ন হয়।
$$2CH_3CHO + O_2 \xrightarrow
[\Delta] {(CH_3COOH)_2, Mn} 2CH_3COOH$$
**প্রোপাইন থেকে
প্রোপানোন প্রস্তুত কর।
-OH ও
-COOH সংযোজন: উচ্চ তাপমাত্রায় ক্ষার (KOH) দ্রবণের উপস্থিতিতে ইথাইন অ্যালকোহলের
সাথে যুক্ত হয়ে ভিনাইল ইথার গঠন করে।
অনুরূপভাবে মারকিউরিক
সালফেটের উপস্থিতিতে 800C তাপমাত্রায় ইথাইন কার্বোক্সিলিক এসিডের সঙ্গে সংযোজন বিক্রিয়ায়
ভিনাইল এস্টার গঠন করে।
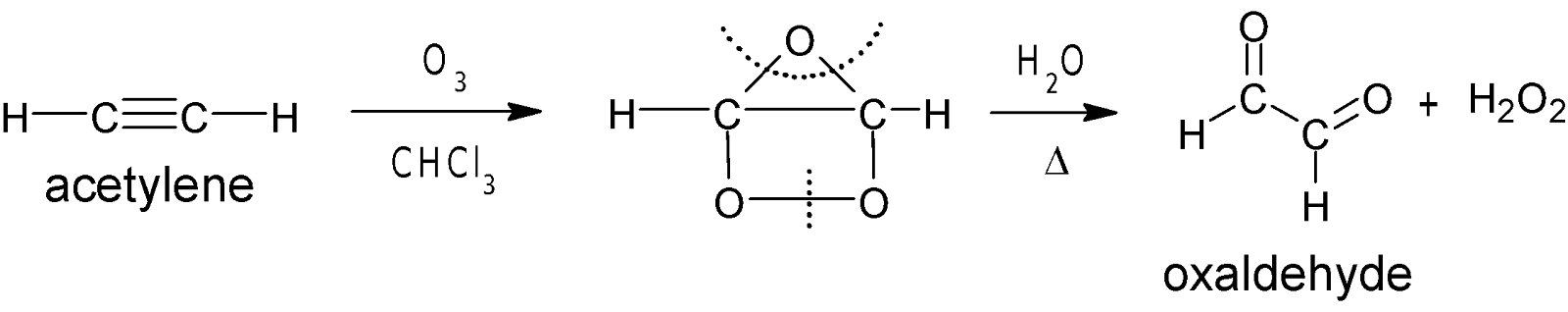
অ্যালকাইনের ওজোনীকরণ
বিক্রিয়া-
ক্লোরোফরম (CHCl3) বা কার্বন টেট্রাক্লোরাইড (CCl4) –এ দ্রবীভূত অ্যালকাইনের দ্রবণে ওজোন গ্যাস
চালনা করলে অ্যালকাইন ওজোনাইড নামক যুত
যৌগ উৎপন্ন হয়। উৎপন্ন ওজোনাইড যৌগকে আর্দ্র বিশ্লেষণ করা হলে ডাইকার্বানাইল যৌগ ও H2O2 উৎপন্ন হয়।
বিক্রিয়ায় উৎপন্ন H2O2 ডাইকার্বনাইল যৌগকে জারিত করে এবং
ত্রিবন্ধনের দুই কার্বনের মাঝখানের বন্ধন ভেঙ্গে গিয়ে কার্বক্সিলিক এসিড উৎপন্ন
করে।
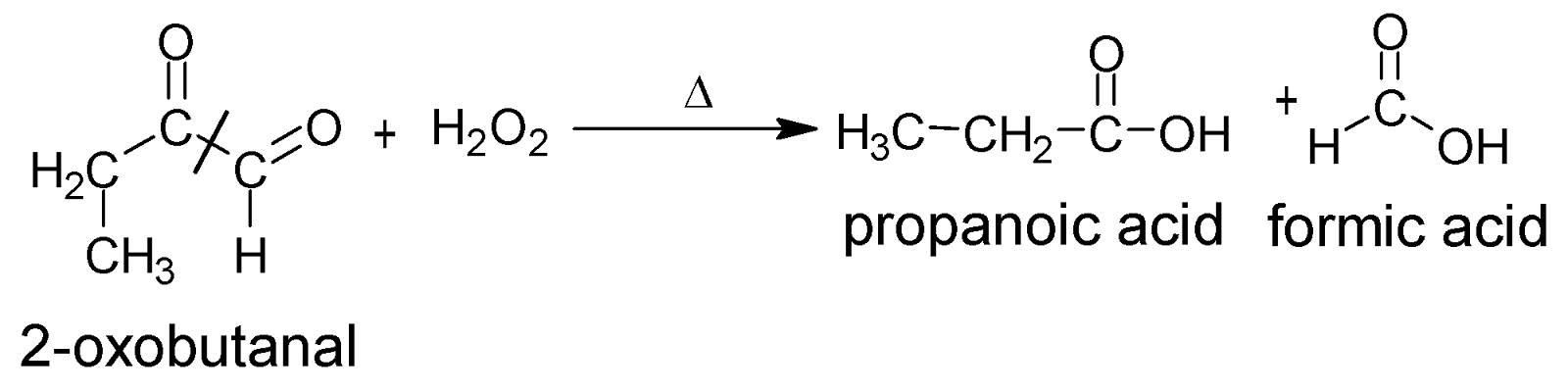
এক্ষেত্রে বিউটাইন-১
এর বেলায় প্রোপানোয়িক এসিড ও মিথানোয়িক এসিডের মিশ্রণ পাওয়া যায়। (অপ্রতিসম অ্যালকাইন-এ বা প্রান্তীয় কার্বনে ত্রিবন্ধন থাকলে দুটি জৈব এসিডের মিশ্রন পাওয়া যাবে।)
এবং বিউটাইন-২ এর
বেলায় ২ অনু ইথানোয়িক এসিড পাওয়া যায়। (প্রতিসম অ্যালকাইন
বা অপ্রান্তীয় অ্যালকাইন (ত্রিবন্ধনের দুপাশে সমান সংখ্যক কার্বন থাকলে)-এ ২ অণু
জৈব এসিড পাওয়া যাবে)
তাই এ বিক্রিয়ার
সাহায্যে অ্যালকাইনে ত্রিবন্ধনের অবস্থান নির্ণয় করা যায়। যেমন-
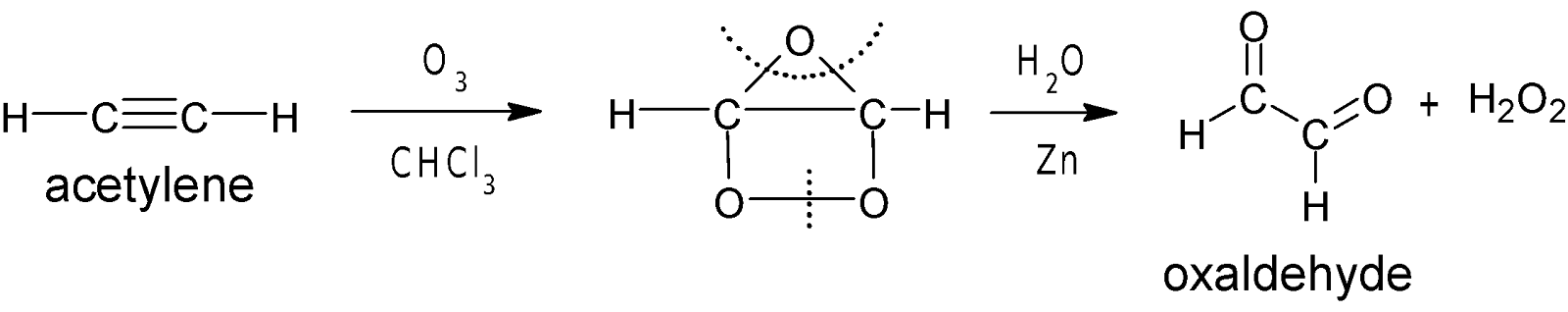
(এই মিশ্রণে Zn
গুঁড়া যোগ করলে অক্সালডিহাইড বা
গ্লাইঅক্সাল $H_2O_2$ দ্বারা জারিত হয়ে ফরমিক এসিডে পরিণত হতে পারে
না)
$$Zn + H_2O_2 \longrightarrow ZnO + H_2O$$
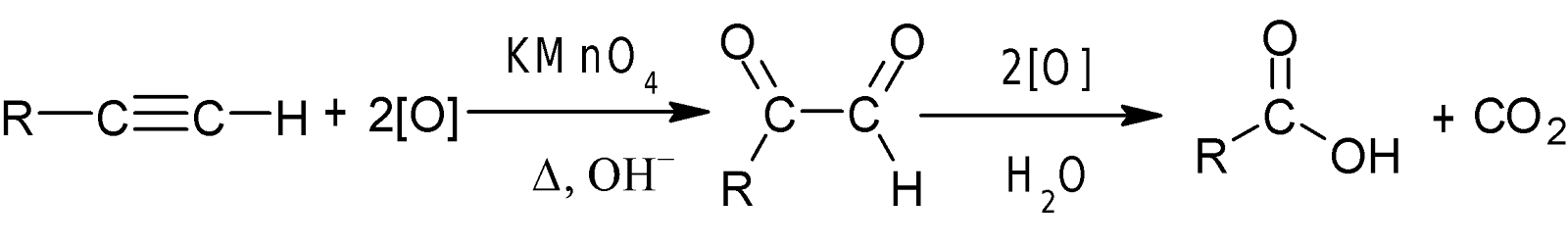
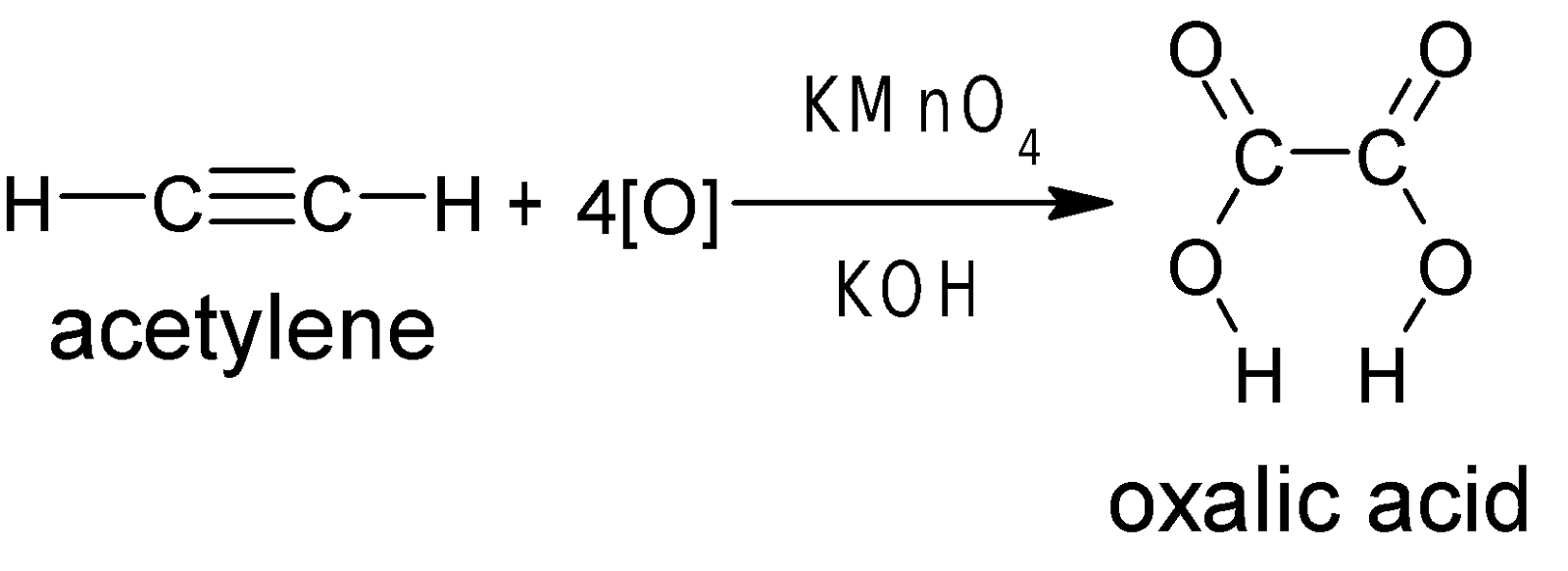
অ্যালকাইনের জারন বিক্রিয়া-
অ্যালকাইনকে ক্ষারীয় KMnO4 দ্বারা উচ্চ তাপমাত্রায় জারিত করলে
ত্রিবন্ধনের জারণ ও ভাঙনের ফলে বিভিন্ন কার্বোক্সিলিক এসিড উৎপন্ন হয়। উৎপন্ন এসিড
শনাক্তকরণের মাধ্যমে ত্রিবন্ধনের অবস্থান নিশ্চিত করা যায়।
যেমন-অ্যালকাইন-১ কে
ক্ষারীয় KMnO4
দ্বার জারিত করলে জৈব
এসিড ও কার্বন-ডাই-অক্সাইড গ্যাস উৎপন্ন হয়।
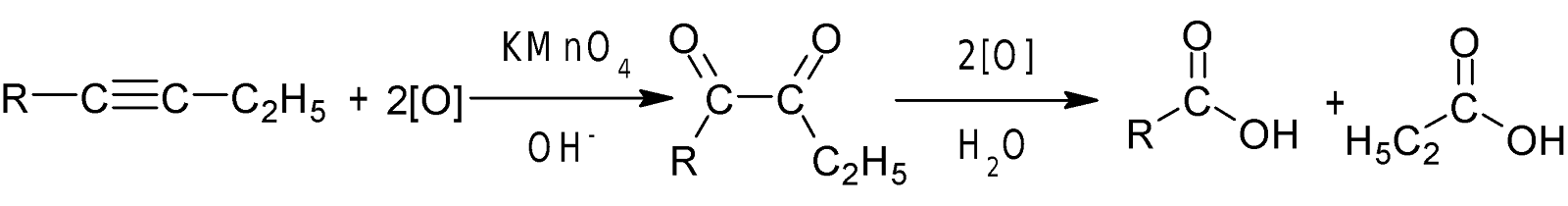
অ্যালকাইন-২ কে
ক্ষারীয় KMnO4
দ্বার জারিত করলে জৈব
এসিড ও অ্যাসিটিক এসিড উৎপন্ন হয়।
অ্যালকাইন-৩ কে
ক্ষারীয় KMnO4
দ্বার জারিত করলে জৈব
এসিড ও প্রোপিয়নিক এসিড উৎপন্ন হয়।
ইথাইন কে ক্ষারীয় KMnO4 দ্বারা জারিত করলে অক্সালিক এসিড উৎপন্ন
হয়।
অ্যালকাইনের অসম্পৃক্ততা (ত্রিবন্ধনের উপস্থিতি) নির্ণয়-
ব্রোমিন পানি পরীক্ষা (Br2 সংযোজন)
অ্যালকাইনের সাথে $Br_2$ এর সংযোজন বিক্রিয়ায় প্রথমে ডাই-হ্যালাইড ও পরে টেট্রা
হ্যালাইড উৎপন্ন হয়। যেমন: :
ইথাইনের সাথে $Br_2$ এর বিক্রিয়ায় প্রথমে ১, ২-ডাইব্রোমো ইথিন এবং পরে ১,১,২,২-
টেট্রাব্রোমো ইথেন উৎপন্ন হয়।
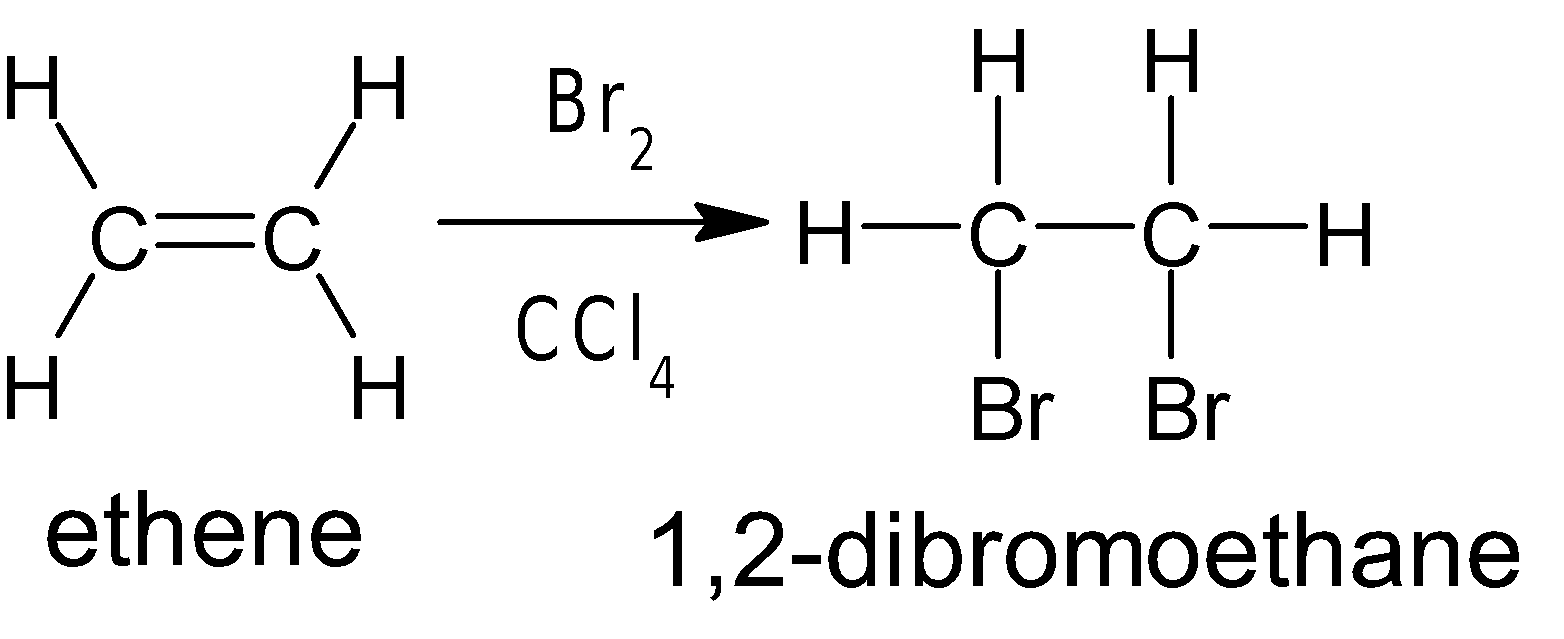
একইভাবে অ্যালকিনের সাথে ও Br2 এর সংযোজন
বিক্রিয়ায় সন্নিহিত ডাই-হ্যালাইড উৎপন্ন হয়। যেমন: ইথিন (CH2=CH2) ও Br2 এর বিক্রিয়ায় ১,২-ডাইব্রোমো ইথেন
উৎপন্ন হয়।
অ্যালকেন এ বিক্রিয়া দেয় না। এ বিক্রিয়ায় ব্রোমিনের লাল বর্ণের জলীয় দ্রবন
দূরীভুত হয় বলে এ বিক্রিয়ার সাহায্যে জৈব যৌগে ত্রিবন্ধন বা দ্বিবন্ধনের উপস্থিতি নির্ণয় করা বা
অসম্পৃক্ততার পরীক্ষা করা যায়।
জারণঃ
অ্যালকাইন-১ কে ক্ষারীয় KMnO4 দ্বার জারিত করলে জৈব এসিড ও কার্বন-ডাই-অক্সাইড গ্যাস উৎপন্ন হয়।
অ্যালকিন ও লঘু ক্ষারীয় KMnO4 এর বিক্রিয়ায় সন্নিহিত ডাই-অল উৎপন্ন হয়। যেমন: যেমন: ইথিন
(CH2=CH2) ও ক্ষারীয় KMnO4 এর বিক্রিয়ায় ইথেন ১,২-ডাইঅল বা ইথিলিন
গ্লাইকল উৎপন্ন হয়।
অ্যালকেন এ বিক্রিয়া দেয় না। এ বিক্রিয়ায় KMnO4 এর গোলাপী বর্ণ
দূরীভুত হয় বলে এ বিক্রিয়ার সাহায্যে জৈব যৌগে ত্রিবন্ধন বা দ্বিবন্ধনের
উপস্থিতি নির্ণয় করা বা অসম্পৃক্ততার পরীক্ষা করা যায়।
অ্যালকাইন-১ ও অ্যালকাইন-২ এবং অ্যালকাইন-১ ও
অ্যালকিন-১ এর পার্থক্য নির্ণয়-
অ্যালকাইন-১ তার
অম্লধর্মীতার জন্য নিম্নোক্ত বিক্রিয়া দেয়-
১। Na -এর সাথে: ইথাইন Na -এর সাথে বিক্রিয়া করে সোডিয়াম অ্যাসিটিলাইড ও $H_2$ গ্যাস উৎপন্ন করে।
$$H-C\equiv C-H + 2Na \xrightarrow [] {liquid NH_3}Na.C\equiv C.Na(s)\downarrow + H_2 (g)$$
$$R-C\equiv C-H + 2Na \xrightarrow [] {liquid NH_3} 2R-Na.C\equiv C.Na(s)\downarrow + H_2$$
$$H-C\equiv C-H + 2Na \xrightarrow [] {liquid NH_3}Na.C\equiv C.Na(s)\downarrow + H_2 (g)$$
$$R-C\equiv C-H + 2Na \xrightarrow [] {liquid NH_3} 2R-Na.C\equiv C.Na(s)\downarrow + H_2$$
২। অ্যামোনিয়া যুক্ত সিলভার নাইট্রেটের সাথে: অ্যামোনিয়া যুক্ত সিলভার নাইট্রেটের সাথে অ্যালকাইন-১ বিক্রিয়া করে সিলভার অ্যালকানাইড এর সাদা অধঃক্ষেপ উৎপন্ন করে।
$$R-C\equiv C-H + Ag(NH_3)_2NO_3(aq) \longrightarrow R.C\equiv C.Ag(s)\downarrow + NH_4NO_3 + NH_3$$
$$H-C\equiv C-H + Ag(NH_3)_2NO_3(aq) \longrightarrow Ag.C\equiv C.Ag(s)\downarrow + NH_4NO_3 + NH_3$$
৩। অ্যামোনিয়া যুক্ত কিউপ্রাস ক্লোরাইড এর সাথে: অ্যামোনিয়া যু্ক্ত কিউপ্রাস ক্লোরাইডের সাথে অ্যালকাইন-১ বিক্রিয়া করে কপার অ্যালকানাইড লাল অধঃক্ষেপ উৎপন্ন করে।
$$R-C\equiv C-H + Cu(NH_3)_2Cl \longrightarrow R.C\equiv C.Cu(s)\downarrow + NH_4Cl + NH_3$$
$$H-C\equiv C-H + Cu(NH_3)_2Cl \longrightarrow Cu.C\equiv C.Cu(s)\downarrow + NH_4Cl + NH_3$$
অ্যালকাইন-২ ও
অ্যালকিন-১ এসব বিক্রিয়া দেয় না।
ইথেন,
ইথিন ও ইথাইন গ্যাসের মিশ্রণ পৃথকীকরণ-
ইথেন, ইথিন ও ইথাইন
গ্যাসের মিশ্রণে অ্যামোনিয়া যু্ক্ত কিউপ্রাস ক্লোরাইডের দ্রবন চালিত করলে লাল
বর্ণের অধঃক্ষেপ হিসেবে ইথাইন শোষিত হয়।
$$H-C\equiv C-H + Cu(NH_3)_2Cl \longrightarrow Cu.C\equiv C.Cu(s)\downarrow + NH_4Cl + NH_3$$
এই অধঃক্ষেপে HCl চালনা করে ইথাইন সংগ্রহ করা হয়।
$$Cu.C\equiv C.Cu + 2HCl
\xrightarrow H-C\equiv C-H + 2CuCl$$
এরপর ইথেন ও ইথিনের
মিশ্রণে গাঢ় $H_2SO_4$ চালনা করলে ইথিন গাঢ় $H_2SO_4$ এ শোষিত হয়ে
ইথাইল হাইড্রোজেন সালফেটে পরিণত হয় এবং ইথেন গ্যাস বুদবুদ আকার বের হয়।
গ্যসটি পানি অপসারণ প্রক্রিয়ায় সংগ্রহ করা হয়। $$CH_2=CH_2 + H_2SO_4
\xrightarrow [] {25^0C} CH_3-CH_2-O-SO_3H$$ এবং সব শেষে উৎপন্ন ইথাইল হাইড্রোজেন
সালফেটকে $160^0C$ তাপমাত্রায় উত্তপ্ত করা হলে ইথিন পাওয়া যায়। $$CH_3-CH_2-O-SO_3H \xrightarrow
[] {160^0C} CH_2=CH_2 + H_2SO_4$$